1. Kvantumszámok
Kvantumszámok = az elektronhéjak azonosítására szolgáló fizikai mennyiségek4 kvantumszám együtt szolgál az elektron egyértelmű beazonosításához:
- főkvantumszám
- mellékkvantumszám
- mágneseskvantumszám
- spinkvantumszám
- jele: n
- Értékeinek jelölése:
- 1 K-héj
- 2 L
- 3 M
- 4 N
mellékkvantumszám = az elektronhéjak normál körülmények közti térbeli alakjára utal.
- jele: l (kis el)
- értéke 0 és n - 1 közötti érték lehet.
- Az értéke azon DOBOZOK SZÁMÁT határozza meg, amelyben az elektronok tartozkodnak.
- Értékek jelölése:
- 0 s pálya (alhéj)
- 1 p
- 2 d
- 3 f
mágneses kvantumszám = az elektronok mágneses térbeli alakjára utal.
- jele: m
- Az értéke a dobozokban lévő REKESZEK SZÁMÁT határozza meg.
- értéke -l és +l között lehet. (Páratlan számú rekesz)
spinkvantumszám = az elektronoknak a mágneses térbeli forgására utal.
- jele:s
- Értéke azt mutatja, hogy egy rekeszbe két különböző elektron fér el.
- értéke +1/2 vagy -1/2 lehet.
2. Az elektronhéjak konkrét felépítése
Tudjuk, hogy- Az elektronok szemléltetésére a fel és a le nyíl szolgál: ↿ ⇂
- Az alhéjakat rekeszekből álló dobozokkal jelöljük.
K-héj:
-
n = 1
alhéjak(egy doboz):
-
1s pálya: ↿ ⇂
L-héj:
-
n = 2
alhéjak (2 doboz):
-
2s (1 rekesz):↿ ⇂
2p (3 rekesz):↿ ⇂↿ ⇂↿ ⇂
M-héj:
-
n = 3
alhéjak:
-
3s (1 rekesz):↿ ⇂
3p (3 rekesz):↿ ⇂↿ ⇂↿ ⇂
3d (5 rekesz):↿ ⇂↿ ⇂↿ ⇂↿ ⇂↿ ⇂
3. Az elektronhéjak betöltődésére vonatkozó szabályok
1. Energia minimum elve: először a legalacsonyabb energiájú hely töltődik fel, aztán a többi.2. Pauli-féle kizárási elv: egy atomban nem lehet két olyan elektron, amelynek mind a négy kvantumszáma azonos.
3. Hund-szabály: az elektronok párosítatlanságra törekszenek.
A Pauli el gyakorlati jelentősége:
Az atomok nagy része üres. A tárgyak az érintkezésük során mégsem hatolnak egymásba, mert az elektronok nem tartózkodhatnak a köztes térben csak meghatározott helyeken.
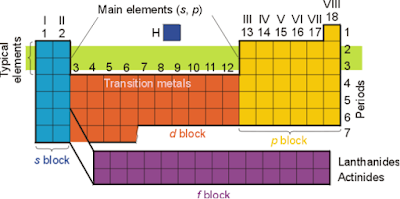
4. Periódusos rendszer felépítése:
Periódusos rendszer:Az atomoknak a legkülső (vegyérték) elektronhéj jellege szerint kialakított táblázata:
| 1H | |||
| 2He | |||
| 3Li | |||
| 4Be | |||
| 5B | |||
| 6C | |||
| 7N | |||
| 8O | |||
| 9F | |||
| 10Ne |
Az elektronhéjak betöltésekor stabil elektronszerkezet jön létre. Ezek a nemesgázok nem lépnek reakcióba más atomokkal.
Periódusos rendszer főbb összetevői:
Periódusok: a vízszintes sorok.
A periódusok száma megegyezik a főkvantumszámmal.
Csoportok: a függőleges oszlopok.
A csoportok száma az elem külső, azaz vegyértékelektronjainak számával.
főcsoport: római számmal jelölt oszlopok
mellékcsoport: egyéb oszlopok.
s-mező elemei: Az első két főcsoportba tartozó elemek (I.A, II.A):
az alkálifémek (I.A)
alkáliföldfémek (II.A)
p-mező elemei: A III. A-VIII. A csoportba tartozó elemek (bór-, szén-, nitrogén-, oxigéncsoport, halogének és a nemesgázok.)
d-mező elemei: I.B-VIII.B mellékcsoportok. Az itt található fémeket átmenetifémeknek nevezzük.
f-mező elemei:
Lantanoidák + Aktinoidák.